Im Dezember 2017 hat die Deutsche Gesellschaft für Rheumatologie erstmalig eine Leitlinie zur Diagnostik und Behandlung von ANCA-assoziierten Vaskulitis-Formen (AAV) veröffentlicht [1]. Zu den AAV zählen die Granulomatose mit Polyangiitis (GPA, früher: Wegener’sche Granulomatose), die mikroskopische Polyangiitis (MPA) und die eosinophile Granulomatose mit Polyangiitis (EGPA, früher: Churg-Strauss-Syndrom). Alle drei gehen mit Autoantikörpern gegen cytoplasmatische Antigene der Granulocyten (ANCA) einher. Die wichtigsten Zielantigene bei AAV sind die Enzyme Proteinase 3 (PR3) bei GPA und Myeloperoxidase (MPO) bei MPA und EGPA.
Die Leitlinie stimmt in weiten Teilen mit aktuell geltenden Empfehlungen der British Society for Rheumatology (BSR), der European League against Rheumatism (EULAR), zusammen mit der European Renal Association (ERA) und dem Canadian Vasculitis Research Network (CanVasc) überein [2].
Diagnostik der ANCA-assoziierten Vaskulitis
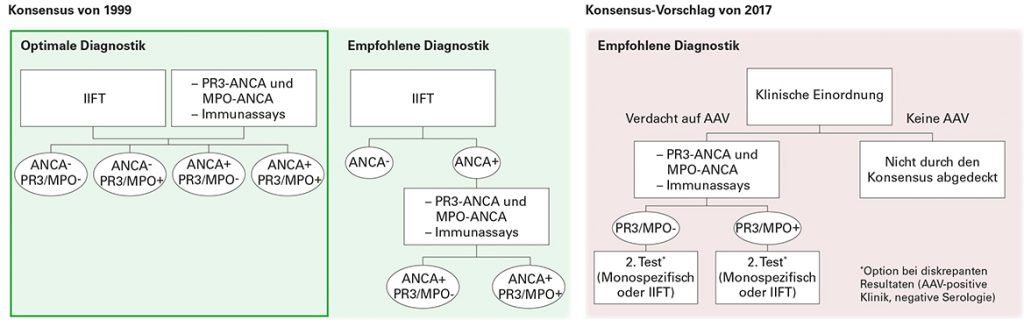
Alle vier Leitlinien fordern eine interdisziplinäre Betreuung der Patienten in Vaskulitis-spezialisierten Zentren, da sich die AAV in diversen klinischen Manifestationen niederschlagen können [2]. Darüber hinaus wird bei einem entsprechenden klinischen Verdacht auf AAV übereinstimmend empfohlen, ANCA rasch durch indirekte Immunfluoreszenz in Kombination mit monospezifischen Immunoassays für Anti-PR3 und Anti-MPO zu bestimmen [2].
Auf internationaler Ebene wird aktuell diskutiert, alternativ die zwei Antigen-spezifischen Immunoassays direkt zum Screening einzusetzen (Positionspapier, [3]). Der Vorschlag basiert vor allem auf den Daten einer retrospektiven multizentrischen Studie der European Vasculitis Study Group mit GPA- und MPA-Patienten. Verglichen wurden monospezifische Immunoassays (PR3, MPO) mit manuellen und automatisierten ANCA-Immunfluoreszenztests verschiedener Hersteller. Im Ergebnis wurde den heutigen monospezifischen Anti-PR3- und Anti-MPO-Assays eine zur Immunfluoreszenz mindestens gleichwertige diagnostische Aussagekraft zugesprochen [4, 5, 6]. Die EUROIMMUN-Systeme (IIFT: EUROPattern EUROPLUS Granulocyten-Mosaik 25; ELISA: Anti-MPO-ELISA, Anti-PR3-hn-hr-ELISA) schnitten in dem Vergleich am besten ab.
Es ist jedoch anzumerken, dass in der Studie weder Verlaufsproben der GPA- und MPA-Patienten noch weitere Vaskulitis-Kollektive (EGPA) oder andere ANCA-assoziierte Krankheitsbilder (z. B. Colitis ulcerosa oder Primär-sklerosierende Cholangitis) berücksichtigt wurden, für deren Diagnostik die neue Strategie ungeeignet ist. ANCA gegen die mit den Nicht-AAV-Erkrankungen assoziierten Zielantigene wie DNA-gebundenes Laktoferrin, Elastase, Kathepsin G oder BPI werden mit den zwei monospezifischen Immuntests nicht erfasst. Zusätzlich weisen selbst die Experten in dem neuen Positionspapier darauf hin, dass sowohl die indirekte Immunfluoreszenz (11-17% negativ) als auch die Immunoassays (9-16% negativ) gleichermaßen ANCA bei AAV-Patienten nachweisen, die in der jeweils anderen Methode negativ getestet wurden [3]. Somit gewährleistet nur die Durchführung beider Testsysteme die höchste diagnostische Sicherheit.
Möglicherweise aufgrund dieser und weiterer ungeklärter Aspekte in dem Positionspapier folgt die neue S1-Leitlinie immer noch den Empfehlungen der gültigen internationalen Konsensus-Statements von 1999 und 2003 [7, 8], die sich für die Kombination aus indirekter Immunfluoreszenz und monospezifischen Immunoassays aussprechen. Zur Sicherung der Diagnose raten alle Expertengruppen zur Entnahme und Analyse einer bioptischen Probe [2].
Verlaufskontrolle der ANCA-assoziierten Vaskulitis
Zur Überwachung des Krankheitsverlaufs einer diagnostizierten AAV ist die Bestimmung der ANCA hingegen nur bedingt geeignet. Weder schließt ein negativer Antikörperbefund eine aktive Erkrankung aus, noch lassen zunehmende Titer zuverlässig ein Rezidiv prognostizieren. Aus diesem Grund betonen die Leitlinien der DGRh ebenso wie die der EULAR/EAR und der BSR, dass eine Modifizierung der Therapie nicht allein auf Basis einer Titer- oder Status-Änderung der ANCA initiiert werden sollte. Empfohlen wird, die Krankheitsaktivität regelmäßig anhand der Klinik zu überprüfen [2].
An verlässlichen Aktivitätsmarkern für Vaskulitis mangelte es bislang. Ein vielversprechender Kandidat bei Vaskulitis mit Nierenbeteiligung ist nun sCD163 im Urin [9]. CD163 ist ein Membranprotein, das auf der Oberfläche von Monocyten und Makrophagen lokalisiert ist. Die lösliche Form, sCD163, entsteht durch die enzymatische Abspaltung der Ektodomäne als Antwort auf proinflammatorische Stimuli. Nach O’Reilly et al. infiltrieren aktivierte Makrophagen bei beginnender Glomerulonephritis, einer charakteristischen klinischen Manifestation der AAV, die Nierenkörperchen und geben sCD163 in den Urin ab. Entsprechend der Hypothese fanden die Wissenschaftler eine enge Assoziation erhöhter sCD163-Level im Urin und aktiver renaler Vaskulitis. Die sCD163-Werte bei Patienten mit akuter Vaskulitis waren deutlich höher als bei Patienten in Remission, mit anderen Erkrankungen oder bei gesunden Kontrollpersonen.
Therapie der ANCA-assoziierten Vaskulitis
Bei der Entscheidung über eine Therapie zur Remissionsinduktion wird unterschieden zwischen AAV-Patienten mit und solchen ohne potenziell lebens-oder organbedrohlichen Manifestationen. Alle vier Leitlinien sind sich einig, dass bei drohenden Organschädigungen Glukokortikoide zusammen mit Cyclophosphamid oder Rituximab verabreicht werden sollten, während bei AAV ohne bedrohliche Organmanifestation eine Therapie aus Glukokortikoiden und Methotrexat empfohlen wird. Bei einer erreichten Remission sollte die Behandlung mit einer mittelpotenten immunsuppressiven Therapie (Azathioprin oder Methotrexat) über 18 bis 24 Monate fortgeführt werden [2].
Trotz vieler Gemeinsamkeiten gibt es auch Unterschiede zwischen den verschiedenen nationalen Empfehlungen [2]. Als Gründe dafür nennt Hellmich zum einen eine lückenhafte Datenbasis, zum anderen nationale Besonderheiten der Gesundheitssysteme. Dennoch bietet die neue Leitlinie der DGRh eine wichtige Hilfestellung, an der sich Kliniker bei der Betreuung der AAV-Patienten orientieren können.
[1] Schirmer JH et al., Z Rheumatol https://doi.org/10.1007/s00393-017-0394-1 (2017) [2] Hellmich B, Z Rheumatol 76:133-142 (2017). [3] Bossuyt X et al., Nat Rev Rheumatol 13(11):683-692 (2017). [4] Csernok et al., Autoimmun Rev 15(7):736-741 (2016). [5] Damoiseaux J et al., Ann Rheum Dis 76(4):647-653 (2017). [6] Bossuyt X et al., Rheumatology (Oxford) 56(9):1633 (2017). [7] Savige J et al., Am J Clin Pathol 111(4):507-513 (1999). [8] Savige J et al., Am J Clin Pathol 120(3):312-318 (2003). [9] O’Reilly at al., J Am Soc Nephrol 27:2906–2916 (2016).