Das bullöse Pemphigoid (BP) gilt mit einer Inzidenz von 1,5-2 Neuerkrankungen pro 100.000 Einwohnern und Jahr als die häufigste Form der blasenbildenden Autoimmundermatosen, besonders bei älteren Menschen. Klinisch zeichnet sich die Erkrankung vor allem durch die Bildung praller Blasen in der Haut sowie durch die Entstehung von Erythemen, krustigen Erosionen und dem Auftreten eines starken Juckreizes aus. Immunologische Kennzeichen des BP sind Autoantikörper gegen zwei Proteine der Hemidesmosomen, BP180 und BP230, die an der Verankerung der epidermalen Zellen in der darunterliegenden Basalmembran beteiligt sind.
80% bis 90% der BP-Patienten entwickeln Antikörper gegen die immun-dominante 16. nicht-kollagene Domäne (NC16A) des BP180, oftmals in Kombination mit Antikörpern gegen weitere Epitope des Proteins. Eine pathogenetische Rolle der Anti-BP180 (NC16A)-Antikörper bei der Entstehung des BP gilt als erwiesen – sie durch Immunadsorption zu entfernen erscheint eine sinnvolle therapeutische Maßnahme. Dabei werden Immunglobuline und Immunkomplexe an eine Matrix gebunden und so aus der Blutzirkulation eines Patienten entfernt.
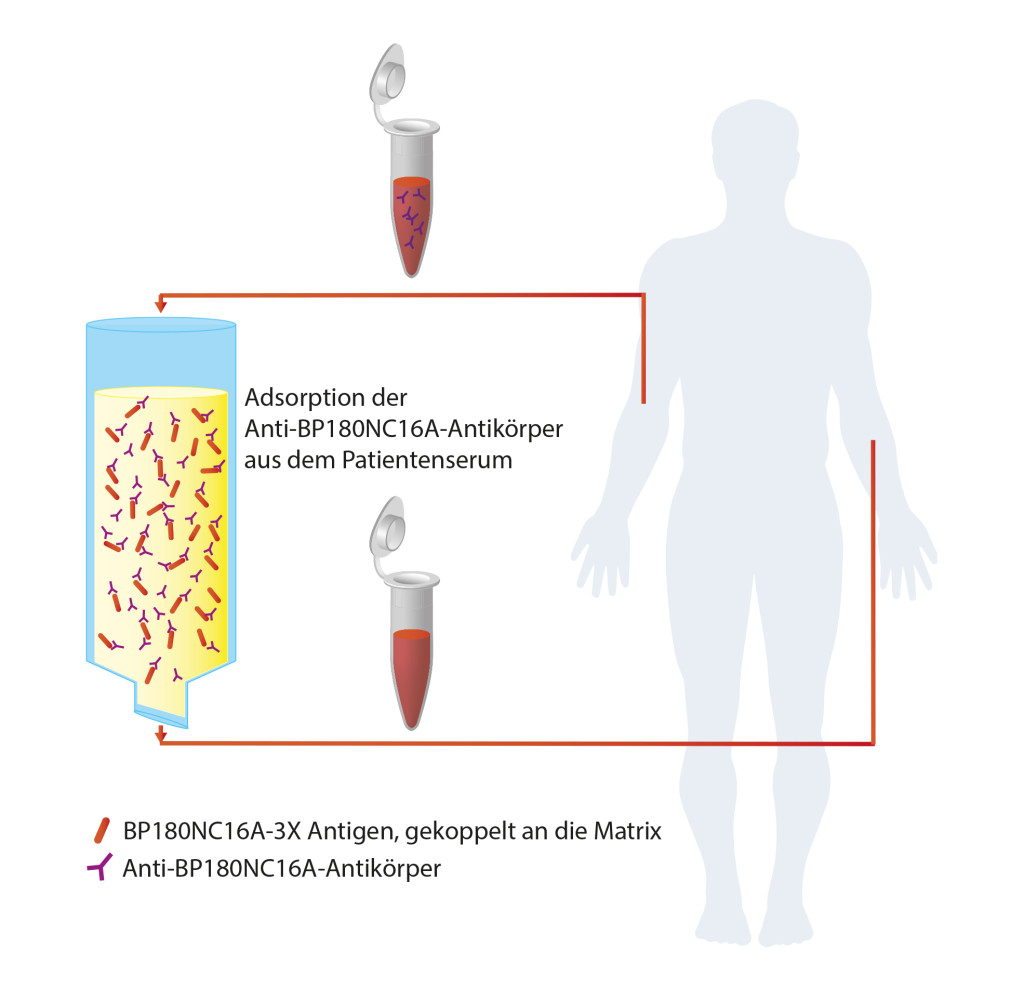
In einer neuen Untersuchung von Mersmann et al. wurde nun ein neuer Immunadsorber, bestehend aus einer Matrix und einem daran gekoppeltem BP180NC16A-3X-Antigen, vorgestellt, der spezifisch Antikörper gegen BP180 NC16A bindet und zur Behandlung von Patienten mit schwerem oder refraktärem BP entwickelt wurde. Messungen der Antikörperkonzentrationen im Serum von 9 BP-Patienten mithilfe des Anti-BP180NC16A-4X-ELISA vor und nach der Inkubation mit der Matrix zeigten, dass das Antikörperlevel durch den Adsorber auf durchschnittlich 2% der Ausgangskonzentration reduziert werden konnte. Unspezifische Antikörperadsorptionen wurden durch Konzentrationsmessungen von Antikörpern gegen Masern Viren und BP230 bestimmt. Ihre Quantität nahm nur um 5% bzw. 9% ab, was für die große Spezifität des Adsorbers spricht.
Zwölf aufeinanderfolgende Adsorptions- und Regenerationszyklen der BP180NC16A-3X-Matrix führten nur zu einer geringen Abnahme der Bindungskapazität um ca. 5%. Bei der Regeneration der Matrix (Elution der gebundenen Antikörper) wird das gekoppelte Antigen also nicht beschädigt, und das System kann für mehrere Adsorptionszyklen eingesetzt werden. Darüber hinaus ist der Adsorber ohne Effizienzverluste autoklavierbar – die Sterilität der Matrix ist Voraussetzung für seine klinische Nutzbarkeit.
Die Immunadsorption mithilfe des hier entwickelten Adsorbers stellt somit eine neue mögliche Methode zur Behandlung von BP-Patienten dar, die derzeit üblicherweise mit starken, immunsuppressiven Medikamenten therapiert werden. Diese können gerade bei den oft älteren Patienten zu erheblichen Nebenwirkungen führen. Nachteilen der bisher durchgeführten generalisierten Immunadsorption, wie einem erhöhten Infektionsrisiko durch unspezifische Entfernung schützender Antikörper, wird durch die Spezifität des Adsorbers für Anti-BP180NC16A- Antikörper entgegengewirkt. Gerade in der Anfangsphase der Behandlung könnte die Immunadsorption wertvoll sein, um die Konzentration der pathogenen Antikörper schnell zu reduzieren.